CTET Chemistry Complete Notes Pdf Download
आज हम आपको CTET Chemistry Complete Notes Pdf Download or CTET Science Chemistry के Complete नोट्स देने जा रहे है वो भी फ्री में | नोट्स की क्वालिटी A+ है | आप चाहे तो पेड नोट्स से इसकी तुलना आमने सामने रखकर कर सकते है |
- यह नोट्स सम्पूर्ण नोट्स है और सभी कोचिंग सेंटर के नोट्स से अच्छे है |
- आप इन नोट्स को किसी भी भाषा में पढ़ सकते है | वेबसाइट पर अपने Upside + on your right (without scroll) की और देखिये |
- हम चाहते है की आप इधर उधर न भटके, अपना समय बर्बाद ना करे सिर्फ अपनी पढाई पर ध्यान दे |
- जैसे हमने आप तक यह नोट्स पहुँचाकर अपना काम पूरा किया है अब आपका फ़र्ज़ बनता है की आप इन नोट्स को अपने दोस्तों के साथ साझा करे, जैसे हमने किया है |
- हमने लालच व संकोच नहीं किया आप भी ना करें, धन्यवाद |
Note:-
CTET Science के नोट्स बहुत सारे है | सभी एक पेज पर नहीं आ पा रहे है तो हमने CTET Science के नोट्स को 4 भागो में बाट दिया है –
- Biology (जीवविज्ञान)
- Physics (भौतिक विज्ञान)
- Chemistry (रसायन विज्ञान)
- Natural Phenomenon and resources (प्राकृतिक घटनाएँ और संसाधन)
Complete CTET Chemistry Notes
(NCERT पुस्तक पर आधारित)
चलिए शुरू करते है इस अनोखी यात्रा को Chemistry (रसायन विज्ञान) के नोट्स के साथ |

पदार्थ
(Substance/Matter)
| अवधारणा | विवरण | उदाहरण |
|---|---|---|
| पदार्थ | कुछ भी जो भार रखता है और जगह लेता है। इसके तीन स्थितियाँ होती हैं: ठोस, तरल और वायुमंडल। | पानी (H₂O) एक पदार्थ का सामान्य उदाहरण है। |
| भार | किसी वस्त्र में मौजूद पदार्थ की मात्रा का माप। | सोने की एक बार की मास को ग्राम में मापा जाता है। |
| आयतन | किसी वस्तु या द्रव्य के द्वारा लिया गया स्थान की मात्रा। | एक तरल की आयतन लीटर में मापा जाता है। |
| घनत्व | एक पदार्थ की इकाई आयतन में मात्रा प्रति भार। यह दिखाता है कि कण कितनी घनता से भरी हुई हैं। | सीसा लकड़ी से ज्यादा घनत्व है। |
| तत्व | एक शुद्ध पदार्थ जो रासायनिक रूप से और किसी भी तरीके से अधिक सरल तत्वों में विभाजित नहीं किया जा सकता है। | ऑक्सीजन (O₂) एक तत्व का उदाहरण है। |
| यौग | दो या दो से अधिक तत्वों की निश्चित अनुपात में रासायनिक रूप से मिश्रण। | पानी (H₂O) एक यौग है जो हाइड्रोजन और ऑक्सीजन से बनता है। |
| मिश्रण | दो या दो से अधिक तत्वों का मिश्रण, जिसमें प्रत्येक तत्व अपनी रासायनिक गुणधर्म बनाए रखता है। | नमक और पानी का मिश्रण एक मिश्रण है। |
| परमाणु | एक तत्व की मौलिक इकाई, जिसमें एक नाभिक (प्रोटॉन और न्यूट्रॉन) और ओर्बिट में इलेक्ट्रॉन होते हैं। | एक कार्बन परमाणु (C) में छह प्रोटॉन और छह इलेक्ट्रॉन होते हैं। |
| यौग | दो या दो से अधिक तत्वों को आपस में रासायनिक रूप से जोड़कर बनाए जाने वाले सार्वभौमिक इकाई। | ऑक्सीजन गैस (O₂) दो ऑक्सीजन परमाणु से बना हुआ एक यौग है। |
| तत्व | एक पदार्थ के लिए रूप या स्थिति में परिवर्तन बिना इसके रासायनिक संरचना में परिवर्तन। | बर्फ को पानी में पिघलना एक भौतिक परिवर्तन है। |
| रासायनिक परिवर्तन | किसी द्रव्य की संरचना में परिवर्तन, जिससे नये गुणधर्मों के साथ एक नया द्रव्य बनता है। | लकड़ी को जलाकर राख और धूआँ बनाना एक रासायनिक परिवर्तन है। |
| पदार्थ की स्थितियाँ | वस्तु के विभिन्न रूप: ठोस, तरल, गैस, और, कुछ मामलों में, प्लाज्मा। | बर्फ (ठोस), पानी (तरल), और भाप (गैस) पदार्थ की स्थितियाँ हैं। |
| ठोस | जिसमें एक निश्चित आकार और आयतन हो, जिसे दृढ़ता से बंधित कण होते हैं। | बर्फ एक ठोस का उदाहरण है। |
| तरल | जिसमें निश्चित आयतन होता है लेकिन कोई विशिष्ट आकार नहीं होता, क्योंकि कण बहते हैं और उपलब्ध स्थान का आकार लेते हैं। | पानी एक तरल का उदाहरण है। |
| गैस | जिसमें कोई निश्चित आकार या आयतन नहीं होता, क्योंकि कण स्वतंत्रता से हिलते हैं और उपलब्ध स्थान को भरते हैं। | ऑक्सीजन गैस एक गैस का उदाहरण है। |
| प्लाज्मा | जिसमें गैस कणों को इतनी ऊर्जा प्रदान की गई है कि इलेक्ट्रॉन किसी भी विशिष्ट परमाणु से संबंधित नहीं होते हैं। | तारे और बिजली एक प्लाज्मा का उदाहरण हैं। |
| रासायनिक सूत्र | एक रासायनिक यौग में अणुओं के प्रकार और संख्या का प्रतिष्ठान। | H₂O पानी के लिए रासायनिक सूत्र को प्रतिष्ठानित करता है। |
| भौतिक गुणधर्म | वस्तु की विशेषताएं जो बिना इसके संरचना को बदले हुए देखी जा सकती हैं या मापी जा सकती हैं। | रंग, घनत्व, और पिघलने का बिंदु भौतिक गुणधर्म हैं। |
| रासायनिक गुणधर्म | विशेषताएं जो किसी द्रव्य के रासायनिक प्रतिक्रिया करने की क्षमता को वर्णित करती हैं और नए द्रव्य की रचना में योगदान करती हैं। | आगजन्यता और प्रतिक्रियाशीलता रासायनिक गुणधर्म हैं। |
| समग्र मिश्रण | एक मिश्रण जिसमें एक यौन संरचना है, जहां घटक समान रूप से वितरित हैं और दृष्टिगत रूप से विभाज्य नहीं हैं। | हवा एक गैसों का समग्र मिश्रण है। |
| विभिन्न मिश्रण | एक मिश्रण जिसमें विशेष रूप से रूपांतरण होती है, जहां घटक दृश्यमान रूप से अलग होते हैं। | विभिन्न सब्जियों के साथ एक सलाद एक विभिन्न मिश्रण है। |
Note: सारणी में दी गई शब्दावली और उदाहरण हैं जो रासायनिक और उसके गुणधर्मों के अध्ययन में सामान्यता से उपयुक्त हैं।
हमारे चारों ओर की वस्तुएँ एक अथवा एक से अधिक पदार्थों से बनी होती हैं। ये पदार्थ काँच, धातुएँ, प्लास्टिक, लकड़ी, रुई, कागज, पंक तथा मृदा हो सकती है |
पदार्थों के गुन
दिखावट:
- पदार्थ जिनमें इस प्रकार की युति होती है, वे प्रायः धातु होते हैं। लोहा, ताँबा, ऐलुमिनियम तथा सोना, धातुओं के उदाहरण हैं। कुछ धातुएँ बहुधा अपनी चमक खो देती हैं और द्युतिहीन (निष्प्रभ) दिखाई देने लगती हैं। ऐसा उन पर वायु तथा नमी ही अभिक्रियाओं के कारण होता है।
- हमें केवल ताजे -कटे पृष्ठों पर ही द्युति दिखाई देती है।
कठोरता:
- पदार्थ जिन्हें आसानी से संपीडित किया अथवा खरोंचा जा सकता है, कोमल पदार्थ कहलाते हैं, जबकि अन्य पदार्थ जिन्हें संपीडित करना कठिन होता है, कठोर पदार्थ कहलाते हैं।
- उदाहरण के लिए रुई अथवा स्पंज कोमल हैं, जबकि लकड़ी कटोर है।
विलेय अथवा अविलेय:
- कुछ पदार्थ जल में पूर्णतः लुप्त हो गए, अर्थात घुल गए (विहीन हो गए थे पदार्थ जल में विलेय हैं। अन्य पदार्थ जल के साथ मिश्रित नहीं होते तथा काफी समय तक गिलास में
विलोड़ित करने पर भी जल में लुप्त नहीं होते। ये पदार्थ जल में अविलेय हैं। - कुछ गैसें जल में विलेय हैं, जबकि अन्य नहीं हैं । सामान्यतः जल में कुछ गैसें रोड़ी मात्रा में विहीन होती है । उदाहरण के लिए जल में विलीन ऑक्सीजन गैस, जल में रहने वाले जंतुओं एवं पादपों की उत्तरजीविता के लिए अत्यंत महत्वपूर्ण
पारदर्शिता:
- उन पदार्थों अथवा सामग्रियों जिनसे होकर वस्तुओ को देखा जा सकता है |
- सकता है, उन्हें पारदर्शी कहते हैं काँच, जल, वायु तथा कुछ प्लास्टिक पारदर्शी पदार्थों के उदाहरण हैं
- ‘कुछ’ ऐसे पदार्थ भी हैं जिनसे होकर आप वस्तुओं को नहीं देख सकते। इन पदार्थों को अपारदर्शी कहते हैं।
- लकड़ी, गत्ता तथा धातुएँ अपारदर्शी पदार्थों के उदाहरण है।
- ऐसे पदार्थों, जिनसे होकर वस्तुओं को देख तो सकते हैं, परंतु बहुत स्पष्ट नहीं देखा जा सकता, उन्हें पारभासी कहते हैं ।
धातु और अधातु
(Metal and non-metal)
| Concept | Description | Example |
|---|---|---|
| Metal | ऐसे तत्व जो आमतौर पर चमकदार दिखते हैं, गर्मी और बिजली का संचालन करते हैं, और लचीले और लचीले होते हैं। | लोहा (Fe) आमतौर पर निर्माण में उपयोग की जाने वाली धातु है। |
| Non-metal | ऐसे तत्व जिनमें आमतौर पर चमकदार उपस्थिति का अभाव होता है, वे गर्मी और बिजली के खराब संवाहक होते हैं, और भंगुर होते हैं। | ऑक्सीजन (O) जीवन प्रक्रियाओं के लिए आवश्यक एक गैर-धातु है। |
| Metalloid | धातुओं और अधातुओं के बीच मध्यवर्ती गुणों वाले तत्व। वे दोनों विशेषताएँ प्रदर्शित कर सकते हैं। | सिलिकॉन (Si) एक उपधातु है जिसका उपयोग अर्धचालक उपकरणों में किया जाता है। |
| Physical State | पारा (Hg) को छोड़कर, जो एक तरल है, धातुएँ आम तौर पर कमरे के तापमान पर ठोस होती हैं। अधातुएँ राज्यों में भिन्न-भिन्न होती हैं। | सोडियम (Na) एक ठोस धातु है, जबकि ऑक्सीजन (O₂) एक गैस अधातु है। |
| Density | धातुओं का घनत्व अधातुओं की तुलना में अधिक होता है। | सोने (Au) का घनत्व सल्फर (S) से अधिक होता है। |
| Melting Point | धातुओं का गलनांक आमतौर पर अधातुओं की तुलना में अधिक होता है। | आयरन (Fe) का गलनांक ऑक्सीजन (O₂) से अधिक होता है। |
| Conductivity | धातुएँ विद्युत की सुचालक होती हैं, जबकि अधातुएँ सामान्यतः कुचालक होती हैं। | कॉपर (Cu) एक उत्कृष्ट चालक है, जबकि सल्फर (S) नहीं है। |
| Malleability | धातुओं को बिना तोड़े पतली शीट में ठोका जा सकता है। अधातुएँ आमतौर पर लचीले नहीं होते हैं। | एल्युमीनियम (Al) लचीला है, जबकि सल्फर (S) लचीला नहीं है। |
| Ductility | धातुओं को खींचकर पतले तार बनाए जा सकते हैं। अधातुएँ सामान्यतः तन्य नहीं होतीं। | सिल्वर (Ag) को तारों में खींचा जा सकता है, जबकि फॉस्फोरस (P) को नहीं। |
| Reactivity | धातुएँ इलेक्ट्रॉन खोने लगती हैं और धनात्मक आयन बनाती हैं। अधातुएँ इलेक्ट्रॉन ग्रहण करती हैं और ऋणात्मक आयन बनाती हैं। | सोडियम (Na) प्रतिक्रिया करके Na⁺ आयन बनाता है, जबकि क्लोरीन (Cl) Cl⁻ आयन बनाता है। |
| Corrosion Resistance | कुछ धातुएँ सुरक्षात्मक ऑक्साइड परत के निर्माण के कारण संक्षारण प्रतिरोध प्रदर्शित करती हैं। अधातुएँ समान प्रकार से संक्षारित नहीं होतीं। | स्टेनलेस स्टील एक संक्षारण प्रतिरोधी धातु है। फ्लोरीन (F₂) एक अधातु है लेकिन संक्षारण नहीं करता है। |
| Metallic Luster | धातुओं में आमतौर पर एक विशिष्ट चमकदार या धात्विक चमक होती है। अधातुओं में इस चमक का अभाव होता है। | चाँदी (Ag) धात्विक चमक प्रदर्शित करती है, जबकि सल्फर (S) नहीं। |
| Examples | सामान्य धातुओं में लोहा (Fe), तांबा (Cu), और सोना (Au) शामिल हैं। सामान्य अधातुओं में ऑक्सीजन (O), सल्फर (S), और फ्लोरीन (F) शामिल हैं। | एल्युमीनियम (Al) एक धातु है, और नाइट्रोजन (N₂) एक अधातु है। |
| Alloys | धातुओं को मिलाकर बेहतर गुणों वाली मिश्रधातुएँ बनाई जा सकती हैं। अधातुएँ आमतौर पर मिश्रधातुएँ नहीं बनाती हैं। | कांस्य, तांबे (Cu) और टिन (Sn) का एक मिश्र धातु, आमतौर पर उपयोग किया जाता है। |
Note: सारणी में दी गई शब्दावली और उदाहरण हैं जो रासायनिक और अधातु-अधातु में अध्ययन करने में सामान्यता से उपयुक्त हैं।
- धातुओं का गुण जिसके कारण उन्हें पीटकर रीट में परिवर्तित किया जा सकता है, आघातवर्धनीयता कहलाता है। यह धातुओं अलाक्षणिक गुण है।
- धातुओं का वह गुण जिससे उन्हें खींचकर तारों में परिवर्तित किया जा सकता है, तन्यता कहलाता है।
धातु एवं अधातु:
- METALS
- NON-METALS
- धातु गायन ध्वनियाँ उत्पन्न करते हैं, वे ध्वानिक कहलाते हैं।
- कुछ पदार्थ कठोर, चमकीले, आघातवर्ध, तन्य, ध्वानिक और ऊष्मा तथा विद्युत के सुचालक होते हैं। पदार्थ जिनमें सामान्यतया ये गुण होते हैं, धातु कहलाते हैं। धातुओं के उदाहरण है – आयरन, कॉपर, ऐलुमिनियम, कैल्शियम, मैग्नेसियम इत्यादि ।
- कोयले और सल्फर जैसे पदार्थ नरम हैं तथा दिखने में मलिन हैं, ये हथौड़े की हलगी चोट से टूटकर चूरा हो जाते हैं, ध्वानिक नहीं हैं और ऊष्मा तथा विद्युत के कुचालक हैं। ये पदार्थ अधातु कहलाते हैं। अधातुओं के उदाहरण हैं. – सल्फर, कार्बन, ऑक्सीजन, फॉस्फोरस, इत्यादि ।
- सोडियम और पोटैशियम धातु नरम होते हैं और उन्हें चाकू से काटा जा सकता है। मर्करी (पारा) केवल ऐसा धातु है जो कमरे के तापम पर द्रव अवस्था में पाया जाता है। ये अपवाद हैं।
- कॉपर में भी जंग लगता है कॉपर के बर्तनों की सतह पर हरा पदार्थ जमा हुआ देखा है।
- जब कॉपर के बर्तन को लम्बे समय तक नम वायु में खुला रखा जाता है तो उस पर एक हलवी हरी परत जम जाती है। यह हरा पदार्थ कॉपर हाइड्रॉक्साइड और कॉपर कार्बोनेट का मिश्रण होता है।
- सोडियम धातु बहुत अभिक्रियाशील होता है। यह ऑक्सीजन और जल के साथ अत्यन्त तीव्र अभिक्रिया करता है। अभिक्रिया में बहुत अधिक ऊष्मा उत्पन्न होती है। इसलिए यह मिट्टी के तेल में संचित रखा जाता है।
- अधातुओं को जल में रखा जाता है। उदाहरण के लिए, फ़ॉस्फोरस एक बहुत सक्रिय अधातु है। वायु में खुला रखने पर यह आग पकड़ लेता है। फ़ॉस्फोरस से वायुमण्डलीय ऑक्सीजन का सम्पर्क न हो, इसलिए उसे जल में रखा जाता है।
- जिंक, कॉपर और आयरन से अधिक अभिक्रियाशील है। एक अधिक अभिक्रियाशील धातु, कम अभिक्रियाशील धातु को विस्थापित कर सकता है
- अधातु जिसका बैंगनी रंग का विलयन एंटीबायोटिक के रूप में घावों पर लगाया जाता है।
ऊष्मा
(Heat)
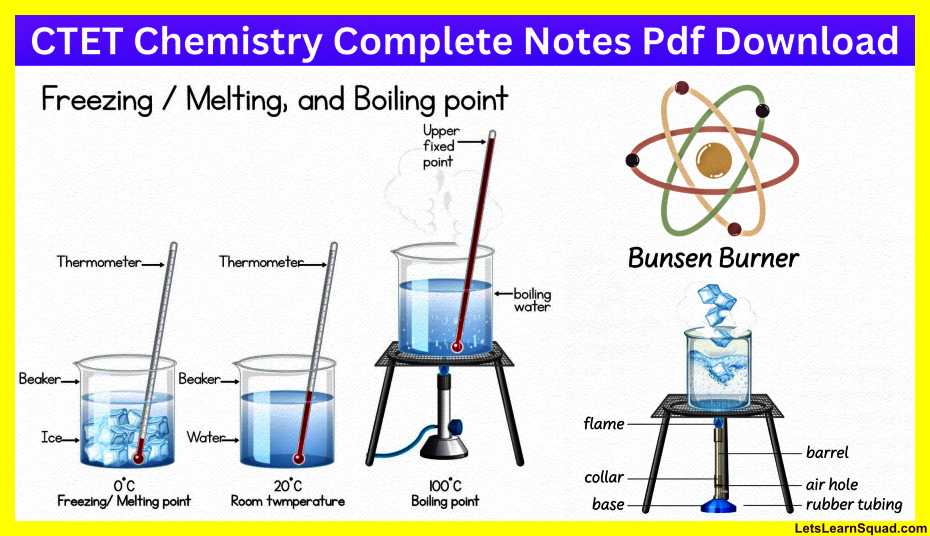
- किसी वस्तु ही उष्णता (गर्मी) की विश्वसनीय माप उसके ताप से की जाती है । ताप मापने के लिए उपयोग की जाने वाली युक्ति को तापमापी (थर्मामीटर) कहते हैं।
ताप-मापन:
- जिस तापमापी से हम अपने शरीर के ताप को मापते हैं उसे डॉक्टरी थर्मामीटर कहते हैं।
- डॉक्टरी थर्मामीटर में एक लंबी, बारीक तथा एक समान व्यास की काँच की नाली होती है।
इसके एक सिरे पर एक बल्व होता है। बल्व में पारा भरा होता है । - उपयोग किए जाने वाला यह मापक्रम सेल्सियस स्केल है, जिसे ‘C द्वारा दर्शाते हैं।
- डॉक्टरी थर्मामीटर से हम 35°C से 42 °C तक के ताप ही माप सकते हैं।
- मानव शरीर का सामान्य ताप 37°C है।
- डॉक्टरी थर्मामीटर को केवल मानव शरीर का ताप मापने के लिए ही डिजाइन किया गया है। मानव शरीर का ताप सामान्यतः 35°C से कम तथा 42 °C से अधिक नहीं होता। यही कारण है कि इस थर्मामीटर का परिसर 35°C से 42 °C है।
प्रयोगशाला तापमापी:
- अन्य वस्तुओं के ताप के लिए अन्य तापमापी काम में लाते हैं। ऐसा ही एक तापमापी, प्रयोगशाला तापमापी है।
- योगशाला तापमापी का परिसर प्रायः 10°C से 110°C होता है
ऊष्मा का स्थानांतरण:
- वास्तव में, ऊष्मा सदैव गर्म वस्तु से अपेक्षाकृत ठंडी वस्तु की ओर प्रवाहित होती है।
- वह प्रक्रम जिसमें ऊष्मा किसी वस्तु के गर्म सिरे से ठंडे सिरे ही ओर स्थानांतरित होती है, चालन कहलाता है।
- जो पदार्थ अपने से होकर ऊष्मा को आसानी से जाने देते हैं उन्हें ऊष्मा का चालक कहते हैं। इनके उदाहरण हैं, ऐलुमिनियम, आयरन ( लोहा) तथा कॉपर (ताँबा ) । जो पदार्थ अपने से होकर ऊष्मा को आसानी से नहीं जाने देते, उन्हें ऊष्मा का कुचालक कहते हैं, जैसे प्लास्टिक तथा लकड़ी। कुचालकों को ऊष्मा-रोधी भी कहते हैं।
- जल तथा वायु ऊष्मा के कुचालक हैं।
- जब जल को गर्म करते हैं, तो ज्वाला के पास का जल गर्म हो जाता है। गर्म जल ऊपर उठता है । इस गर्म जल के आस-पास का ठंडा जल उसका स्थान लेने के लिए आ जाता है । फिर यह जल भी गर्म होकर ऊपर उठता है तथा आस-पास से जल फिर इसके स्थान पर आ जाता है। यह प्रक्रिया तब तक चलती रहती है जब तक कि सारा जल गर्म न हो जाए । ऊष्मा स्थानांतरण की इस विधि को संवहन कहते हैं।
- सूर्य से हम तक ऊष्मा एक अन्य प्रक्रम द्वारा आती है जिसे विकिरण कहते हैं। विकिरण द्वारा ऊष्मा के स्थानांतरण में किसी माध्यम जैसे वायु अथवा जल की आवश्यकता नहीं होती।
- सभी गर्म पिंड विकिरणों के रूप में ऊष्मा विकिरित करते हैं। जब थे ऊष्मा विकिरण किसी अन्य वस्तु से टकराते हैं, तो इनका कुछ भाग परावर्तित हो जाता है, कुछ भाग अवशोषित हो जाता है तथा कुछ भाग परागत हो सकता है। ऊष्मा के अवशोषित भाग के कारण वस्तु का ताप बढ़ जाता है।
अम्ल और क्षारक
(Acid and Base)
| अवधारणा | विवरण | उदाहरण |
|---|---|---|
| अम्ल
(Acid) |
पदार्थ जो आकाशीय विलयन में हाइड्रोजन आयन () मुक्त करते हैं। इनका pH 7 से कम होता है। | हाइड्रोक्लोरिक एसिड () एक तेज अम्ल है। |
| क्षारक
(Base) |
पदार्थ जो आकाशीय विलयन में हाइड्रॉक्साइड आयन () मुक्त करते हैं। इनका pH 7 से अधिक होता है। | सोडियम हाइड्रॉक्साइड () एक तेज क्षारक है। |
| pH स्केल
(pH Scale) |
एक स्केल जो एक विलयन की अम्लता या क्षारकता को मापने के लिए प्रयुक्त होती है। यह 0 से 14 तक होता है, जहां 7 न्यूट्रल है। | नींबू का रस का pH लगभग 2 है, जिससे यह अम्ल है। |
| समता विलयन
(Neutralization) |
अम्ल और क्षारक के बीच एक प्रतिक्रिया जिससे पानी और एक लवण उत्पन्न होते हैं। इससे विलयन का pH संतुलित होता है। | |
| तेज अम्ल
(Strong Acid) |
वे अम्ल जो पूरी तरह से पानी में विभाजित होते हैं, अपने सभी हाइड्रोजन आयनों को मुक्त करते हैं। | सल्फ्यूरिक एसिड () एक तेज अम्ल है। |
| कमजोर अम्ल
(Weak Acid) |
वे अम्ल जो पूरी तरह से पानी में विभाजित नहीं होते, केवल उनके कुछ ही हाइड्रोजन आयनों को मुक्त करते हैं। | एसीटिक एसिड () एक कमजोर अम्ल है। |
| तेज क्षारक
(Strong Base) |
वे क्षारक जो पूरी तरह से पानी में विभाजित होते हैं, अपने सभी हाइड्रोक्साइड आयनों को मुक्त करते हैं। | सोडियम हाइड्रॉक्साइड () एक तेज क्षारक है। |
| कमजोर क्षारक
(Weak Base) |
वे क्षारक जो पूरी तरह से पानी में विभाजित नहीं होते, केवल उनके कुछ ही हाइड्रोक्साइड आयनों को मुक्त करते हैं। | अमोनिया () एक कमजोर क्षारक है। |
| ब्रॉन्स्टेड-लोवरी अम्ल
(Bronsted-Lowry Acid) |
वे पदार्थ जो एक रासायनिक प्रतिक्रिया में प्रोटॉन (H⁺ आयन) दान करते हैं। | हाइड्रोक्लोरिक एसिड () एक ब्रॉन्स्टेड-लोवरी अम्ल के रूप में कार्य करता है। |
| ब्रॉन्स्टेड-लोवरी क्षारक
(Bronsted-Lowry Base) |
वे पदार्थ जो एक रासायनिक प्रतिक्रिया में प्रोटॉन (H⁺ आयन) स्वीकार करते हैं। | अमोनिया () एक ब्रॉन्स्टेड-लोवरी क्षारक के रूप में कार्य करता है। |
| ल्यूइस अम्ल
(Lewis Acid) |
वे पदार्थ जो एक रासायनिक प्रतिक्रिया में इलेक्ट्रॉन जोड़ स्वीकार करते हैं। | बोरॉन ट्राइफ्लोराइड () एक ल्यूइस अम्ल के रूप में कार्य करता है। |
| ल्यूइस क्षारक
(Lewis Base) |
वे पदार्थ जो एक रासायनिक प्रतिक्रिया में इलेक्ट्रॉन जोड़ दान करते हैं। | अमोनिया () एक ल्यूइस क्षारक के रूप में कार्य करता है। |
| संजुग अम्ल
(Conjugate Acid) |
जब एक अधातु प्रोटॉन हासिल करती है, तो जो प्रदान होता है। | |
| संजुग क्षारक
(Conjugate Base) |
जब एक अम्ल प्रोटॉन हासिल करता है, तो जो बनता है। | |
| एम्फोटेरिक
(Amphoteric) |
वे पदार्थ जो परिस्थितियों के आधार पर एक साथ अम्ल और क्षारक के रूप में कार्य कर सकते हैं। | पानी () एक एम्फोटेरिक मोलेक्यूल है। |
| एम्ल वर्षा
(Acid Rain) |
जिसमें pH 5.6 से कम होता है, जिसमें सल्फ्यूरिक एसिड और नाइट्रिक एसिड जैसे अम्ल शामिल होते हैं। | |
| अलकलिनिटी
(Alkalinity) |
जब एक अम्ल या क्षारक जोड़ा जाता है, तो पानी की pH में परिवर्तन को रोकने की क्षमता। | कार्बोनेट और बायकार्बोनेट पानी की अलकलिनिटी में योगदान करते हैं। |
Note: सारणी में दी गई शब्दावली और उदाहरण हैं जो रासायनिक अम्ल और क्षारक के अध्ययन में सामान्यता से उपयुक्त हैं।
- दही, नींबू का रस, संतरे का रस और सिरके का स्वाद खट्टा होता है। इन पदार्थों का स्वाद खट्टा इसलिए होता है, क्योंकि इनमें अम्ल (Acid) होते हैं। ऐसे पदार्थों की रासायनिक प्रकृति अम्लीय होती है। एसिड शब्द की उत्पत्ति लैटिन शब्द एसियर से हुई है, जिसका अर्थ है खट्टा। इन पदार्थों भें पाए जाने वाले अम्ल प्राकृतिक अम्ल होते हैं।
- ऐसे पदार्थ, जिनका स्वाद कड़वा होता है और जो स्पर्श करने पर साबुन जैसे लगते हैं, क्षारक कहलाते हैं। इन पदार्थों की प्रकृति क्षारवीय कहलाती है।
- कोई पदार्थ अम्तीय है अथवा क्षारवीय, इसका परीक्षण करने के लिए विशेष प्रकार के पदार्थों का उपयोग किया जाता है। ये पदार्थ सूचक कहलाते हैं । सूचकों को जब अम्लीय अथवा छारकीय पदार्थयुक्त विलयन में मिलाया जाता है, तो उनका रंग बदल जाता है। हल्दी, लिटमस, गुड़हल की पंखुड़ियाँ आदि कुछ प्राकृतिक रूप से पाए जाने वाले सूचक है |
अम्ल का नाम:
- ऐसीटिक अम्ल
- फॉर्मिक अम्ल
- साइट्रिक अम्ल
- लैक्टिक अम्ल
- ऑक्सलिक अम्ल
- ऐस्कॉर्बिक अम्ल (विटामिन C )
- टार्टरिक अम्ल
किसमे पाया जाता है:
- सिरका
- चींटी का डंक
- सिट्रस फल जैसे संतरा, नींबू
- दही
- पालक
- आँवला, सिट्रस फल
- इमली, अंगूर, कच्चे आम आदि
क्षारक का नाम
- कैल्सियम हाइड्रॉक्साइड
- अमोनियम हाइड्रॉक्साइड
- सोडियम हाइड्रॉक्साइड / पोटैशियम हाइड्रॉक्साइड
- मैग्नेसियम हाइड्रॉक्साइड
किसमे पाया जाता है:
- चूने का पानी
- खिड़वी के काँच आदि, साफ़ करने के लिए ‘उपयुक्त’ ‘मार्जक
- साबुन
- दूधिया मैग्नेसियम
लिटमस
- सबसे सामान्य रूप से उपयोग किया जाने वाला’ प्राकृतिक
सूचक लिटमस है। इसे लाइकेनों (शैक) से निष्कर्षित किया जाता है। - जब इसे अम्लीय विलयन में मिलाया जाता है, तो यह लाल जाता है और जब क्षारीय विलयन में मिलाया जाता है, तो
यह नीला हो जाता है। यह विलयन के रूप में अथवा कागज़ की पट्टियों के रूप में उपलब्ध होता है जिन्हें लिटमस पत्र कहते हैं । - ऐसे विलयन, जो लाल अथवा नीले लिटमस पत्र पत्र के रंग को परिवर्तित नहीं करते, उदासीन विलयन कहलाते हैं। ऐसे पदार्थ न तो अम्लीय होते हैं और न ही क्षारकीय ।
उदासीनीकरण:
- जब किसी अम्लीय विलयन में क्षारीय विलयन मिलाया जाता है तो दोनों विलयन एक दूसरे के प्रभाव को उदासीन कर देते हैं ।
उदासीनीकरण:
अम्ल + क्षार
लवण + जल
- उदासीनीकरण अभिक्रिया में नया पदार्थ निर्मित होता है, जो लवण कहलाता है। किसी अम्ल और किसी क्षारक के बीच होने वाली अभिक्रिया उदासीनीकरण कहलाती है। * इस प्रक्रम में ऊष्मा के निर्मुक्त होने के साथ-साथ लवण और जल निर्मित होते हैं।
- अम्ल + क्षारक → लवण + जल ( ऊष्मा निर्मुक्त होती है)

भौतिक परिवर्तन
(Physical Change)
- पदार्थ के आकार, आमाप (साइज़), रंग और अवस्था जैसे गुण उसके भौतिक गुण कहलाते हैं। वह परिवर्तन, जिसमें किसी पदार्थ केभौतिक गुणों में परिवर्तन हो जाता है, भौतिक परिवर्तन कहलाता है। भौतिक परिवर्तन सामान्यतः उत्क्रमणीय होता है। ऐसे परिवर्तन में या पदार्थ नहीं बनता है ।
- लोहे में जंग लगना एक ऐसा परिवर्तन है, जिससे आप भली-भाँति परिचित हैं। यदि आप लोहे के एक टुकड़े को कुछ दिनों के लिए खुले में छोड़ दें, तो इस पर भूरे रंग के पदार्थही परत जम जाती है। यह पदार्थ जंग कहलाता है और यह प्रक्रम जंग लगना कहलाता है
- जंग लोहा नहीं है। जंग उस पदार्थ (लौह ) से भिन्न होती है, जिस पर यह लगती है।
- वह परिवर्तन, जिसमें एक अथवा एक-से अधिक नए पदार्थ बनते हैं, रासायनिक परिवर्तन कहलाता है। रासायनिक परिवर्तन को रासायनिक अभिक्रिया भी कहते हैं ।
- सभी नए पदार्थ रासायनिक परिवर्तनों के परिणामस्वरूप ही बनते हैं। उदाहरण के लिए, भोजन का पाचन, फलों का पकना, अंगूरों का किण्वन आदि विभिन्न रासायनिक परिवर्तनों के कारण होता है।
लोहे को जंग से बचाना
(Protecting Iron from Rust)
- वास्तव में, यदि वायु में आर्द्रता ही मात्रा अधिक हो, अर्थात् नमी अधिक हो, तो जंग जल्दी लगती है।
- इसका एक सरल उपाय उन पर पेट अथवा ब्रीज ही एक परत चढ़ाना है। वास्तव में, लोहे की सभी वस्तुओं पर नियमित रूप से पैंट अथवा गीज़ की परत चढ़ाते रहना चाहिए, जिससे उनमें जंग लगने को रोका जा सके। एक अन्य उपाय लोहे के ऊपर क्रोमियम अथवा जस्ता (जिंक) जैसी किसी धातु की परत चढ़ाना है। लोहे पर जिंक की परत चढ़ाने का प्रक्रम यशद्- लेपन (गैल्वेनाइजेशन) कहलाता है।
- स्टेनलेस स्टील लोहे में कार्बन और क्रोमियम, निकैल तथा भैंगनीज जैसी धातुओं को मिलाकर बनाया जाता है। इसमें जंग नहीं लगती है |
प्राकृतिक संसाधन
(Natural Resources)
| अवधारणा | विवरण | उदाहरण |
|---|---|---|
| प्राकृतिक संसाधन
(Natural Resources) |
प्राकृतिक वातावरण से प्राप्त पदार्थ और सामग्री, जो जीवों द्वारा उनके लाभ के लिए प्रयुक्त होती हैं। | जल, हवा, मृदा, खनिज, और वन्यजन्य संसाधन प्राकृतिक संसाधन हैं। |
| नवीनीकृत संसाधन
(Renewable Resources) |
संसाधन जो प्राकृतिक प्रक्रियाओं के माध्यम से तेजी से पुनर्निर्मित या पुनः स्थानांतरित किया जा सकता है। | सौर ऊर्जा, वायु ऊर्जा, और बायोमास नवीनीकृत संसाधन हैं। |
| अनवरत संसाधन
(Non-renewable Resources) |
संसाधन जो सीमित हैं और उन्हें अच्छी तरह से एक छोटे समय में पुनः स्थानांतरित किया नहीं जा सकता है। | जीवाश्म (कोयला, तेल, प्राकृतिक गैस) अनवरत संसाधन हैं। |
| जीवाश्म
(Fossil Fuels) |
पौधों और जीवों के अवशिष्टों से बने कार्बन-युक्त सामग्री, जो सामान्यत: ऊर्जा स्रोतों के रूप में प्रयुक्त होती है। | कोयला, पेट्रोलियम, और प्राकृतिक गैस जीवाश्म के उदाहरण हैं। |
| वैकल्पिक ऊर्जा स्रोत
(Alternative Energy Sources) |
ऊर्जा स्रोत जो पर्यावरण के प्रति दयालु माने जाते हैं और पारंपरिक स्रोतों से कम हानिकारक होते हैं। | सौर ऊर्जा, वायु ऊर्जा, और जलशक्ति वैकल्पिक ऊर्जा स्रोत हैं। |
| संरक्षण
(Conservation) |
प्राकृतिक संसाधनों का उपयोग करने के लिए उनके सतत उपयोग और प्रबंधन का योजनात्मक अनुप्रयोग। | वन्यजन्य संसाधनों की रक्षा उन्हें सुरक्षित रखने के लिए की जाती है। |
| जैव विविधता
(Biodiversity) |
किसी विशेष आवास में जीवन जंतुओं की विविधता, जो पारिस्थितिक और अभिलंबन की दृष्टि से समृद्धि और सहनशीलता में योगदान करती है। | अमेज़ॅन वन्यजन्यता में धनी है, जिसमें विभिन्न पौधों और जीवों की बहुरूपता है। |
| वन्याभूती
(Deforestation) |
वन्य या वृक्षारोपण के लिए वनों को स्वच्छ करने या हटाने की प्रक्रिया, जो अधिकांशकर कृषि या औद्योगिक उद्देश्यों के लिए होती है। | अमेज़ॅन वन्याभूति में से एक प्रमुख वन्यभूति क्षेत्र है। |
| जल संरक्षण
(Water Conservation) |
जल का अभिशासन करने और इसका अत्यधिक उपयोग से बचाव करने के लिए विधियाँ और रणनीतियाँ। | टपक सिंचाई और वर्षा जल संरक्षण विधियाँ हैं। |
| सतत कृषि
(Sustainable Agriculture) |
पर्यावरण की सुरक्षा करने, मृदा उर्वरता बनाए रखने और दीर्घकालिक खाद्य उत्पादन को समर्थन करने का उद्देश्य रखने वाली खेती विधियाँ। | कार्बनिक खेती और वृक्षीय कृषि सतत कृषि के उदाहरण हैं। |
| मृदा क्षय
(Soil Erosion) |
मृदा की क्षय और हानि की प्रक्रिया, जो अक्सर हवा या पानी द्वारा कारणित होती है, जिससे प्राकृतिक उर्वरता में कमी होती है। | अधिरक्षण और अयोग्य भूमि प्रबंधन मृदा क्षय को बढ़ाते हैं। |
| ओजोन परत की कमी
(Ozone Layer Depletion) |
धरती के स्त्रातोस्फियर में ओजोन परत में कमी, जो अक्सर मानव निर्मित पदार्थों के कारण होती है। | क्लोरोफ्लुओरोकार्बन्स (CFCs) ओजोन परत की कमी के मुख्य कारण हैं। |
| हरितागृही गैस
(Greenhouse Gases) |
धरती के वायुमंडल में ऊर्जा को बंद करने वाले गैसें, जो हरितागृही प्रभाव और जलवायु परिवर्तन में योगदान करती हैं। | कार्बन डाइऑक्साइड (CO2), मीथेन (CH4), और नाइट्रस ऑक्साइड (N2O) हरितागृही गैसें हैं। |
| जलवायु परिवर्तन
(Climate Change) |
लम्बे समय तक ताप, वर्षा, और अन्य वायुमंडलीय शर्तों में परिवर्तन, जो अक्सर मानव गतिविधियों का लाभ होता है। | ग्लोबल वॉर्मिंग जलवायु परिवर्तन का एक परिणाम है। |
| ऊर्जा संरक्षण
(Conservation of Energy) |
ऊर्जा नहीं बनाई जा सकती, केवल एक रूप से दूसरे रूप में परिणाम हो सकता है, इसे ऊर्जा संरक्षण का सिद्धांत कहा जाता है। | एक ऊर्जा प्रवाह एक पारिस्थितिक ऊर्जा संरक्षण के सिद्धांत का पालन करता है। |
| नवीनीकृत ऊर्जा प्रमाण पत्र
(Renewable Energy Certificates (RECs)) |
एक प्रणाली जो नवीनीकृत स्रोतों से उत्पन्न ऊर्जा की पर्यावरणीय गुणधर्मों को प्रतिष्ठित करने वाली ट्रेडेबल प्रमाण पत्रों को प्रतिनिधित्व करती है। | एआरईसी नवीनीकृत ऊर्जा का समर्थन और प्रोत्साहन करने का एक तरीका प्रदान करते हैं। |
Note: सारणी में दी गई शब्दावली और उदाहरण हैं जो प्राकृतिक संसाधनों और पर्यावरण विज्ञान के अध्ययन से संबंधित हैं।
Also read: SlidesharePPT
प्राकृतिक संसाधनों को व्यापक रूप से 2 वर्गों में बाँटा जा सकता है |
1. अक्षय प्राकृतिक संसाधन:
- ये संसाधन प्रकृति में असीमित मात्रा में उपस्थित है और मानवीय क्रियाकलापों से समाप्त होने वाले नहीं हैं। उदाहरण हैं – सूर्य का प्रकाश , वायु |
2. समाप्त होने वाले प्राकृतिक संसाधन:
- प्रकृति में इन स्रोतों की मात्रा सीमित है। ये मानवीय क्रियाकलापों द्वारा समाप्त हो सकते हैं। इन संसाधनों के उदाहरण हैं- वन, वन्यजीव, खनिज, कोयला, पेट्रोलियम, प्राकृतिक गैस, आदि ।
- कोयले, पेट्रोलियम और प्राकृतिक गैसों जैसे कुछ समाप्त होने वाले प्राकृतिक संसाधनों इनका निर्माण सजीव प्राणियों के मृत अवशेषों (जीवाश्मों) से होता है। अतः इन्हें जीवाश्मी ईंधन कहते हैं।
कोयला:
- खाना पकाने हेतु उपयोग आने वाले ईंधनों में कोयला एक है। पहले इसका उपयोग रेल इंजनों को चलाने के लिए भाप बनाने में होता था । इसका उपयोग तापीय शक्ति संयत्रों में विद्युत् उत्पन्न करते हेतु भी किया जाता है। कोयले का उपयोग विभिन्न उद्योगों में ईंधन के रूप में भी किया जाता है।
- उच्च दाब और उच्च ताप पर, पृथ्वी के भीतर मृत पेड़-पौधे धीरे-धीरे कोयले में परिवर्तित हो गए। कोयले में मुख्य रूप से कार्बन होता है। मृत वनस्पति के धीमे प्रक्रम द्वारा कोयले में परिवर्तन को कार्बनीकरण कहते हैं।
- वायु में गर्म करने पर कोयला जलता है और मुख्य रूप से कार्बन डाइऑक्साइड गैस उत्पन्न करता है।
कोक:
- यह एक कठोर, सरंध्र और काला पदार्थ है। यह कार्बन का लगभग शुद्ध रूप है। कोक का उपयोग इस्पात के औद्योगिक निर्माण और धातुओं के निष्कर्षण में किया जाता है।
कोलतार:
- यह एक अप्रिय गंध वाला काला गाढ़ा द्रव होता है। यह लगभग 200 पदार्थों का मिश्रण होता है। कोलतार से प्राप्त उत्पादों का उपयोग प्रारम्भिक पदार्थों के रूप में दैनिक जीवन में काम आने वाले विभिन्न पदार्थों के औद्योगिक निर्माण में तथा उद्योगों, जैसे- संश्लेषित रंग, औषधि, विस्फोटक, सुगंध, प्लास्टिक, पेन्ट, फोटोग्रैफिक सामग्री, छत-निर्माण सामग्री, आदि में होता है।
- आजकल पक्की सड़कों के निर्माण में कोलतार के स्थान पर एक पेट्रोलियम उत्पाद बिटुमेन का प्रयोग किया जाता है।
कोयला गैस:
- कोयले के प्रक्रमण द्वारा कोक बनाते समय कोयला गैस प्राप्त होती है। यह कोयला प्रक्रमण
संयंत्रों के निकट स्थापित बहुत से उद्योगों में ईंधन के रूप में उपयोग की जाती है। - लंदन में 1810 में तथा न्यूयार्क में 1820 के आस-पास कोयला गैस का उपयोग प्रथम बार सड़कों पर रोशनी के लिए किया गया था। आजकल इसका उपयोग रोशनी के बजाय ऊष्मा के स्रोत के रूप में किया जाता है।
पेट्रोलियम:
- भारी मोटर वाहनों जैसे ट्रकों और ट्रैक्टरों को चलाने के डीज़ल काम आता है। ये ईंधन प्राकृतिक स्रोत से प्राप्त होते है | जिसे पेट्रोलियम कहते हैं।
- पेट्रोलियम का निर्माण समुद्र में रहने वाले जीवों से हुआ। जब ये जीव मृत हुए, इनके शरीर समुद्र के पैदे में जाकर जम गए और फिर रेत तथा मिट्टी की तहों द्वारा ढक गए। लाखों वर्षों में, वायु की अनुपस्थिति, उच्च ताप और उच्च दाब ने मृत जीवों को पेट्रोलियम और प्राकृतिक गैस में परिवर्तित कर दिया।
- पेट्रोलियम गहरे रंग का तेलीय द्रव सी गंध अप्रिय होती है। यह विभिन्न संघटकों, जैसे- पेट्रोलियम गैस, पेट्रोल, डीजल, स्नेहक तेल, पैराफिन मोम, आदि का मिश्रण होता है। पेट्रोलियम के विभिन्न संघटकों/प्रभाजों को पृथक करने का प्रक्रम परिष्करण कहलाता है। यह कार्य पेट्रोलियम परिष्करणी में सम्पादित किया जाता है
प्राकृतिक गैस
- प्राकृतिक गैस एक बहुत महत्वपूर्ण जीवाश्म ईंधन है, क्योंकि इसका परिवहन पाइपों द्वारा सरलतापूर्वक हो जाता है। प्राकृतिक गैस को उच्च दाब पर संपीडित प्राकृतिक गैस (CNG) रूप में भंडारित किया जाता है। सीएनजी का उपयोग ऊर्जा उत्पादन हेतु किया जाता है। अब
- इसका उपयोग परिवहन वाहनों में ईंधन के रूप में किया जा रहा है क्योंकि यह कम प्रदूषणकारी है। यह एक स्वच्छ ईंधन है।
दहन
(Combustion)
रासायनिक प्रक्रम जिसमें पदार्थ ऑक्सीजन से अभिक्रिया कर ऊष्मा देता है, दहन कहलाता है। जिस पदार्थ का दहन होता है, वह दाहय कहलाता है। इसे ईंधन भी कहते हैं। ईंधन टोस, द्रव या गैस हो सकता है। कभी- कभी, दहन के समय ज्वाला के रूप में अथवा एक लौ के रूप में प्रकाश भी उत्पन्न होता है।
- गर्मियों के मौसम में बहुत अधिक गर्मी पड़ने पर कुछ स्थानों पर सूखी घास आग पकड़ लेती है। घास से आग पेड़ों में फैलती है और जल्द ही पूरा जंगल आग की चपेट में आ जाता है।
- वह न्यूनतम ताप जिस पर कोई पदार्थ जलने लगता है, उसका ज्वलन – ताप कहलाता है।
- जिन पदार्थों का ज्वलन ताप बहुत कम होता है और जो ज्वाला के साथ सरलतापूर्वक आग पकड़ लेते हैं, ज्वलनशील पदार्थ कहलाते हैं। ज्वलनशी पदार्थ के उदाहरण है | पेट्रोल, ऐल्कोहल, द्रवित पेट्रोलियम गैस (LPG ) etc.
दहन के प्रकार:
- गैस स्टोव की धुंडी (नॉब) घुमाकर गैस चालू कर दीजिए। आप देखते हैं कि गैस तेज़ी से जलने लगती है तथा ऊष्मा और प्रकाश उत्पन्न करती है। इस प्रकार का दहन तीव्र दहन कहलाता है।
- फॉस्फोरस जैसे कुछ पदार्थ हैं जो कमरे के ताप पर वायु में जल उठते हैं।
- इस प्रकार का दहन जिसमें पदार्थ, बिना किसी प्रत्यक्ष कारण के, अचानक लपटों के साथ जल उठता है, स्वतः दहन कहलाता है।
ज्वाला:
- ज्वाला या लौ दहन का दिखाई देने वाला गैसीय अवयव है। यह अत्यधिक ऊष्माक्षेपी दहन क्रियाओं में दिखता है।
- सोने और चाँटी को पिघलाने के लिए सुनार धातु की फुकनी से ज्वाला के सबसे बाहगी भाग को उस पर फूँकते हैं।
ईंधन दक्षता:
- ईंधन के 1 किलोग्राम के पूर्ण दहन से प्राप्त ऊष्मा ऊर्जा ही मात्रा, उसका ऊष्मीय मान कहलाती है। ईंधन के उष्मीय मान को किलोजूल प्रति किलोग्राम (kJ/kg) मात्रक द्वारा प्रदर्शित किया जाता है।
Read the Previous Post: CTET Physics Complete Notes Pdf Download







